

Sie befinden sich hier: Home : Industriegase Lexikon: Wärmekapazität von Gasen
Die spezifische Wärmekapazität eines idealen Gases kann durch zwei verschiedene Bezugsgrößen ausgedrückt werden.
Dient als Bezugsgröße 1 Kg eines bestimmten Gases, so spricht man von der spezifischen Wärmekapazität. Hierbei kann die spezifische Wärmekapazität als die
Wärmemenge betrachtet werden, die notwendig ist, um 1 Kg eines Gases um 1 K zu erwärmen.
Dient als Bezugsgröße 1 kmol eines Gases, so spricht man von der molaren Wärmekapazität.
Weiterhin wird unterschieden zwischen der Wärmekapazität bei konstantem Druck bzw. bei konstantem Volumen.
| cv | spezifische Wärmekapazität bei konstantem Volumen |
| cp | spezifische Wärmekapazität bei konstantem Druck |
| cmv | molare Wärmekapazität bei konstantem Volumen |
| cmp | molare Wärmekapazität bei konstantem Druck |
Die Differenz der beiden spezifischen Wärmekapazitäten entspricht beim idealen Gas der speziellen Gaskonstanten Ri.
cp-cv = cons t= Ri
Das Verhältnis der spezifischen Wärmekapazitäten wird mit χ bezeichnet und berechnet sich wie folgt:
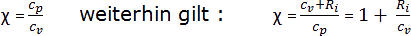
Durch die Differenzbeziehung der spezifischen Wärmekapazitäten in Form der speziellen Gaskonstanten Ri ergibt sich eine Temperaturunabhängigkeit der Beziehung, obwohl die spezifischen Wärmekapazitäten für sich genommen temperaturabhängig sind.
cp - cv = const = Ri
Die molare Wärmekapazität eines idealen Gases lässt sich leicht mit Hilfe der molaren Masse M aus der spezifischen Wärmekapazität ableiten. Es gilt:
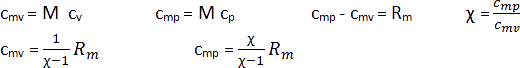
Die Differenz der beiden molaren Wärmekapazitäten entspricht der molaren Gaskonstanten Rm auch allgemeine Gaskonstante genannt. Die molaren Wärmekapazitäten idealer Gase hängen nur von Rm und χ ab. χ als das Verhältnis der spezifischen Wärmekapazitäten bei idealen Gasen wird auch als Isentropenexponent bezeichnet.
Der Isentropenexponent für das Ideale Gas ist nur abhängig von der Anzahl der Freiheitsgrade der Teilchen, die wiederum davon abhängig ist, wie viele Atome ein Gas besitzt.
| FR | χ |  |
 |
|
| 1 - atomig | 3 | 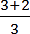 =1,6 =1,6 |
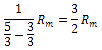 |
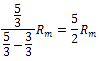 |
| 2 - atomig | 5 | 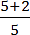 =1,4 =1,4 |
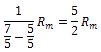 |
FR = Freiheitsgrade
Diese Modellvorstellungen gelten beim idealen Gas aber nur innerhalb bestimmter Grenzen. So ist z.B. beim zweiatomigen idealen Gas eine Modellgenauigkeit nur in der Größenordnung der normalen Raumtemperatur gegeben, da mit steigender Temperatur die beiden Atome auch innerhalb des Moleküls in Längs- und Querrichtung schwingen. hieraus ergibt sich:
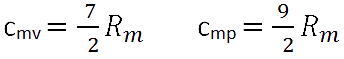
Bei niedrigen Temperaturen kommt sowohl die Schwingungsbewegung wie auch die Rotationsbewegung zum Stillstand. Mit fallender Temperatur nähert sich somit die molare Wärmekapazität der Beziehung:

Bei mehr als zweiatomigen idealen Gasen ist eine auf den Freiheitsgraden basierte einfache Methode nicht mehr möglich, da weitere Freiheitsgrade auftreten. Die Werte für χ = 1,333 auf Basis von 3-atomigen Gasen mit 6 Freiheitsgraden werden jedoch gelegentlich in der Literatur genannt
Zur Berechnung der mittleren spezifischen Wärmekapazität kann folgende Gleichung verwendet werden.
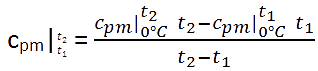
Ein Beispiel soll die Verwendung veranschaulichen.
Die mittlere spezifische Wärmekapazität bei konstantem Druck (1 bar) soll für Stickstoff in dem Temperaturbereich t1=200°C bis t2=1200°C berechnet werden.
cp200°C = 1,052 kJ/kgK, t1 = 200°C
cp1200°C= 1,242 kJ/kgK, t2 = 1200°C
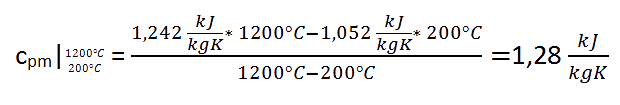
| Gas | Chemisches Symbol |
Molares Volumen Vmn bei 0°C, 1,01325 bar [m3/kmol] |
Molare Masse M in kg/kmol | Spezielle Gaskonstante Ri J/kg K |
Allgemeine Gaskonstante Rm J/kmol K |
χ = cp/cv |
| Acetylen | C2H2 | 22,226 | 26,038 | 319,6 | 8314,4 | 1,268 |
| Argon | Ar | 22,392 | 39,948 | 208,1 | 8314,4 | 1,667 |
| Helium | He | 22,46 | 4,0026 | 2077,2 | 8314,4 | 1,657 |
| Kohlendioxid | CO2 | 22,261 | 44,0098 | 189 | 8314,4 | 1,301 |
| Kohlenmonoxid | CO | 22,4 | 28,0104 | 297 | 8314,4 | 1,4 |
| Luft | --- | 22,401 | 28,965 | 287,2 | 8314,4 | 1,4 |
| Sauerstoff | O2 | 22,392 | 31,99988 | 259,8 | 8314,4 | 1,397 |
| Stickstoff | N2 | 22,403 | 28,0134 | 296,9 | 8314,4 | 1,4 |
| Wasserstoff | H2 | 22,428 | 2,0158 | 4124,9 | 8314,4 | 1,409 |
Vmn : bei 0°C, 1,01325bar
χ : Isentropenexponent χ = cp/cv Werte in der Tabelle bei 0°C und idealem Gaszustand
| Gas | Vmn |
M | Ri |
Rm |
χ |
| Acetylen, C2H2 | 22,226 | 26,038 | 319,6 | 8314,4 | 1,268 |
| Argon, Ar | 22,392 | 39,948 | 208,1 | 8314,4 | 1,667 |
| Helium, He | 22,46 | 4,0026 | 2077,2 | 8314,4 | 1,657 |
| Kohlendioxid, CO2 | 22,261 | 44,0098 | 189 | 8314,4 | 1,301 |
| Kohlenmonoxid, CO | 22,4 | 28,0104 | 297 | 8314,4 | 1,4 |
| Luft | 22,401 | 28,965 | 287,2 | 8314,4 | 1,4 |
| Sauerstoff, O2 | 22,392 | 31,99988 | 259,8 | 8314,4 | 1,397 |
| Stickstoff, N2 | 22,403 | 28,0134 | 296,9 | 8314,4 | 1,4 |
| Wasserstoff, H2 | 22,428 | 2,0158 | 4124,9 | 8314,4 | 1,409 |
Vmn : [m3/kmol] Molares Volumen bei 0°C, 1,01325 bar
M : [kg/kmol] Molare Masse
Ri : [J/kgK] Spezielle Gaskonstante
Rm : [J/kgK] Allgemeine Gaskonstante
χ = Isentropenexponent, χ=cp/cv, Werte in der Tabelle bei 0°C und idealem Gaszustand
Anhand der Polynongleichung cp = a + bT + cT2 + dT3 [kJ/kgK]
kann die spezifische Wärmekapazität für konstanten Druck in einem begrenzten Temperaturbereich berechnet werden. Werte für die Konstanten a bis d finden Sie für verschiedene Gase hier:
| Gas | CO2 | Luft | O2 | N2 |
| Tmin [K] | 200 | 250 | 250 | 250 |
| Tmax [K] | 590 | 600 | 760 | 775 |
| a | 0,443144 | 1,02251 | 0,929187 | 1,08756 |
| b | 1,68846E-03 | -1,75903E-04 | -3,21846E-04 | -3,52343E-04 |
| c | -1,26874E-06 | 4,02136E-07 | 1,16635E-06 | 7,20138E-07 |
| d | 3,47034E-10 | -4,86946E-11 | -7,11728E-10 | -2,81547E-10 |
Hieraus berechnete Werte für die spezifische Wärmekapazität in [kJ/kgK] bei konstantem Druck (1 bar) für verschiedene Temperaturen finden Sie hier.
| T [k] | CO2 | Luft | O2 | N2 |
| 250 | 0,791 | 1,003 | 0,911 | 1,040 |
| 255 | 0,797 | 1,003 | 0,911 | 1,040 |
| 260 | 0,802 | 1,003 | 0,912 | 1,040 |
| 265 | 0,808 | 1,003 | 0,913 | 1,040 |
| 270 | 0,813 | 1,003 | 0,913 | 1,039 |
| 273,15 | 0,817 | 1,003 | 0,914 | 1,039 |
| 293,15 | 0,838 | 1,004 | 0,917 | 1,039 |
| 313,15 | 0,858 | 1,005 | 0,921 | 1,039 |
| 333,15 | 0,878 | 1,007 | 0,925 | 1,040 |
| 353,15 | 0,896 | 1,008 | 0,930 | 1,041 |
| 373,15 | 0,915 | 1,010 | 0,935 | 1,042 |
| 393,15 | 0,932 | 1,013 | 0,940 | 1,043 |
| 413,15 | 0,949 | 1,015 | 0,945 | 1,045 |
| 433,15 | 0,965 | 1,018 | 0,951 | 1,047 |
| 453,15 | 0,980 | 1,021 | 0,957 | 1,050 |
| 473,15 | 0,995 | 1,024 | 0,963 | 1,052 |
| 493,15 | 1,009 | 1,028 | 0,969 | 1,055 |
| 513,15 | 1,022 | 1,032 | 0,975 | 1,058 |
| 533,15 | 1,035 | 1,036 | 0,981 | 1,062 |
| 553,15 | 1,048 | 1,040 | 0,988 | 1,065 |
| 573,15 | 1,059 | 1,045 | 0,994 | 1,069 |
Wir haben für Sie weitere spezifische Wärmekapazitäten berechnet. Die Tabelle können Sie im unteren Bereich über den gekennzeichneten Button öffnen.
cp° = a + bt + ct2 + dt3+ e/t2 [J/molK]
mit t=T/1000 ;
T: Absolute Temperatur; 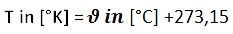
Werte für die Konstanten a bis e finden Sie für verschiedene Gase hier:
| Gas | Ar | N2 | CO2 | O2 |
| Bereich | 298-6000K | 100K-500K | 298K-1400K | 100K-700K |
| a | 2,0786E+01 | 28,98641 | 24,99735 | 31,32234 |
| b | 2,825911E-07 | 1,853978 | 55,18696 | -20,2353 |
| c | -1,464191E-07 | -9,647459 | -33,6913 | 57,86644 |
| d | 1,092131E-08 | 16,63537 | 7,948387 | -36,5062 |
| e | -3,661371E-08 | 0,000117 | -0,13663 | -0,00737 |
| Bereich | ---- | 500K-2000K | 1400K-6000K | 700K-2000K |
| a | ---- | 19,50583 | 58,16639 | 30,03235 |
| b | ---- | 19,88705 | 2,720074 | 8,77297 |
| c | ---- | -8,598535 | -0,4922 | -3,98813 |
| d | ---- | 1,369784 | 0,038844 | 0,78831 |
| e | ---- | 0,527601 | -6,4472 | -0,7415 |
Zur Umrechnung der spezifischen Wärmekapazität von J/molK in kJ/kgK müssen die Ergebnisse der Shomate Gleichung durch die entsprechenden Molmasse des gerechneten Gases dividiert werden.
In der Tabelle unterhalb haben wir die Ergebnisse gemäß der Shomate Gleichung den Ergebnissen der Polynomgleichung für die Gase Stickstoff und Sauerstoff gegenübergestellt.
| Gleichung | Shomate | Polynom | Shomate | Polynom |
| Temp. [K] | N2 | N2 | O2 | O2 |
| 298,15 | 1,040 | 1,039 | 0,918 | 0,918 |
| 300,15 | 1,040 | 1,039 | 0,919 | 0,918 |
| 313,15 | 1,040 | 1,039 | 0,921 | 0,921 |
| 333,15 | 1,041 | 1,040 | 0,925 | 0,925 |
| 353,15 | 1,041 | 1,041 | 0,929 | 0,930 |
| 373,15 | 1,042 | 1,042 | 0,934 | 0,935 |
| 393,15 | 1,044 | 1,043 | 0,939 | 0,940 |
| 413,15 | 1,045 | 1,045 | 0,944 | 0,945 |
| 433,15 | 1,047 | 1,047 | 0,950 | 0,951 |
| 453,15 | 1,049 | 1,050 | 0,956 | 0,957 |
| 473,15 | 1,052 | 1,052 | 0,963 | 0,963 |
| 493,15 | 1,055 | 1,055 | 0,969 | 0,969 |
| 513,15 | 1,058 | 1,058 | 0,976 | 0,975 |
| 533,15 | 1,061 | 1,062 | 0,982 | 0,981 |
| 553,15 | 1,065 | 1,065 | 0,989 | 0,988 |
| 573,15 | 1,069 | 1,069 | 0,995 | 0,994 |
Beachten Sie unbedingt, dass die Konstanten der Polynomgleichung nicht auf die Shomate Gleichung angewendet werden können. Umgekehrt gilt dies natürlich auch.